Menu
Medical Device Regulation (MDR)
Prêt à démarrer avec le nouveau règlement européennes sur les dispositifs médicaux
Le règlement sur les dispositifs médicaux (MDR) est un règlement européen sur les dispositifs médicaux entré en vigueur fin mai 2017 (UE 2017/745). Après une période de transition, qui a été prolongée pour des raisons de coronavirus, les exigences doivent être appliquées à partir du 26 mai 2021 au plus tard. Tant pour les fabricants de dispositifs médicaux que pour les distributeurs, des changements significatifs doivent être mis en œuvre au plus tard à la date limite.
Amoena est bien préparée pour l'application du nouveau règlement sur les dispositifs médicaux à partir du 26 mai. En mettant en œuvre les exigences MDR, nous les avons rendues aussi pratiques, simples et transparentes que possible pour les deux parties - pour nous en tant que fabricant et pour nos partenaires de distribution.
Quels sont les effets visibles du MDR?
Selon le MDR, des informations étendues sont nécessaires pour l'étiquetage des dispositifs médicaux. À l'avenir, en plus du code qui identifie clairement les produits, vous trouverez d'autres données et symboles sur l'emballage et l'étiquette. Les produits sous la responsabilité d'Amoena Medizin-Orthopädie-Technik GmbH (distributeur et fabricant) peuvent être reconnus par notre adresse derrière un symbole d'usine noir sur l'étiquette ou l'emballage:
 Amoena Medizin-Orthopädie-Technik GmbH
Amoena Medizin-Orthopädie-Technik GmbH
Kapellenweg 36, 83064 Raubling, Germany
www.amoena.com
Que se passe-t-il avec les produits plus anciens (voir art. 120 al. 4 MDR)?
Les produits avec d'anciennes étiquettes peuvent :
- être vendu par vos soins en tant que revendeur spécialisé jusqu'en mai 2025,
- astant que la date d'expiration n'est pas dépassée avant cette date.
- Ceci s'applique également aux produits arrivés à votre entrepôt de consignation avant le 26 mai 2021. Ceux-ci sont considérés comme ayant été mis sur le marché et n'ont pas besoin d'être réétiquetés.
Quelles sont les exigences en matière d'étiquetage des produits?
En plus du marquage CE bien connu, vous trouverez également quelques nouveaux symboles que nous aimerions vous présenter ci-dessous :
Icône | Explication |
 | Date de péremption : À partir de la date de validité du MDR, les produits doivent comporter une date de fabrication ou de péremption. Nos produits d’entretien de la prothèse mammaire et les prothèses mammaires porteront une date de péremption. La date de péremption est déterminée sur la base d'études de durée de conservation. Les produits périmés ne peuvent plus être vendus. |
 | Date de fabrication (= date d'expédition): À partir de la date de validité du MDR, les produits doivent comporter une date de fabrication ou de péremption. Nos produits Recovery Care et Textiles porteront une date de fabrication. |
 | Numéro de référence : Le symbole est affiché avant le numéro d'article. |
 | Numéro de série : Le symbole est affiché avant le numéro de série. |
 | Numéro du lot de production : Le symbole est affiché avant le numéro du lot de production. |
 | Le symbole "MD" signifie Medical Device - ce symbole est affiché pour indiquer que le produit est un dispositif médical. |
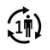 | Patient unique - usage multiple : Le produit peut être utilisé plusieurs fois par un seul patient. |
 | Pour plus d'informations, consultez le mode d'emploi. |
| | Si l'emballage est endommagé, le produit ne doit pas être utilisé. |
 | Les produits sous la responsabilité d'Amoena GmbH (fabricant) peuvent être reconnus par notre adresse derrière un symbole d'usine noir sur l'étiquette ou l'emballage. |
 | Protéger du soleil. |
 | Stocker dans un espace sec. |
Qu'en est-il des instructions d'utilisation?
Dans le cas très improbable d'un «incident grave» avec un dispositif médical de notre classe de risque, le législateur nous oblige à faire référence à une obligation de déclaration dans la notice d'utilisation. De plus, comme l'exige le MDR, vous trouverez également nos instructions d'utilisation actuelles sur notre page d'accueil au plus tard à la date limite.
Pour toute question complémentaire concernant le MDR, n'hésitez pas à nous contacter.




